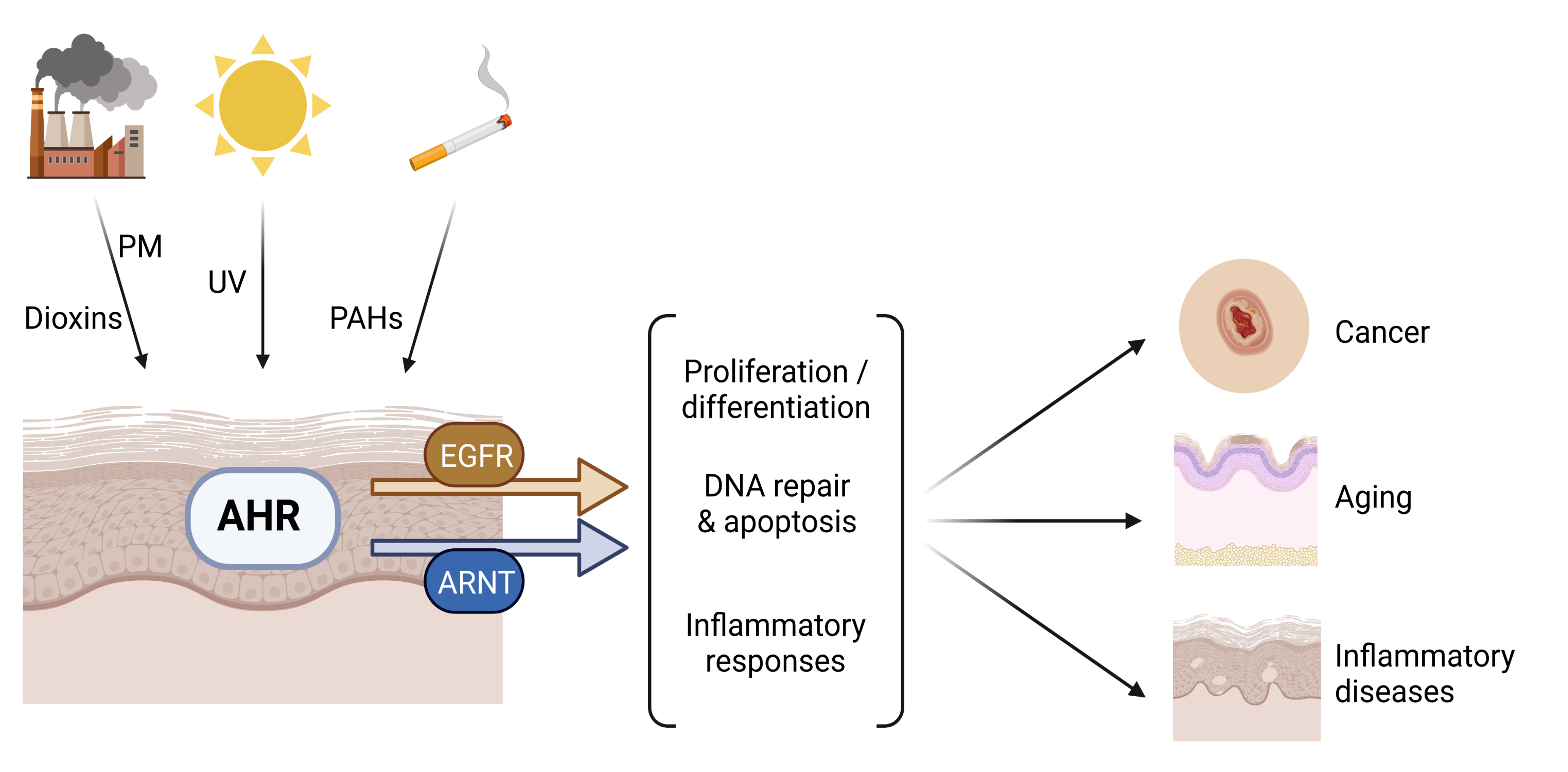
Unsere Arbeitsgruppe untersucht die biologischen Funktionen des Arylhydrokarbon-Rezeptors (AHR)-Signalweges in der mit Umweltfaktoren exponierten Haut. Das Hauptaugenmerk unserer Forschung liegt auf der Aufklärung neuer Funktionen des AHR innerhalb der Stressantwort kutaner Zellen, insbesondere epidermaler Keratinozyten, auf eine Exposition gegenüber ultravioletter Strahlung (UV) und ubiquitärer Umweltschadstoffe, wie polyzyklische aromatische Kohlenwasserstoffe (PAK) und Dioxine. Das übergeordnete Ziel ist es, neue molekulare Angriffspunkte für die Entwicklung präventiver und/oder therapeutischer Maßnahmen gegen umweltinduzierte Hauterkrankungen zu identifizieren. So konnten wir erstmalig aufzeigen, dass der AHR entscheidend zur Photokarzinogenese der Haut bei Mäusen beiträgt, indem er sowohl die Nukleotidexzisionsreparatur als auch die Apoptose in UVB-bestrahlten Keratinozyten unterdrückt. Aktuell untersuchen wir die potenzielle Bedeutung von Wechselwirkungen zwischen verschiedenen exposomalen Faktoren für adaptive und maladaptive Stressreaktionen der Haut. Im Kontext der Hautalterung und -Krebsentstehung führen wir gemeinsam mit dem Krutmann-Labor vergleichende Analysen von UVA- und UVB-Bestrahlungsprotokolle mit singulärer, sequentieller und gleichzeitiger Exposition durch. Mittels Kombination von chemischer Behandlung und UV-Exposition untersuchen wir, ob eine Modulation der DNA-Reparatur durch AHR-Agonisten die UVB-initiierte Hautkrebsentstehung bei Mäusen beeinflusst. Erst kürzlich konnten wir zeigen, dass PAKs, aber nicht dioxin-ähnliche Stoffe, die Expression der Aldo-Keto-Reduktase (AKR) 1C3 und die damit verbundene 11-Ketoreduktion von Prostaglandin D2 über einen nicht-kanonischen AHR-Signalweg stimulieren. Der daraus resultierende Metabolit, 9α,11β-Prostaglandin F2, kann Th2-vermittelte Entzündungsreaktionen stimulieren und aufrechterhalten und somit den Krankheitsverlauf der atopischen Dermatitis verstärken. In Zusammenarbeit mit der Arbeitsgruppe Schikowski untersuchen wir derzeit, ob ein Gain-of-Function-Polymorphismus in der kodierenden Region des AKR1C3-Gens die individuelle Suszeptibilität gegenüber der durch partikuläre Luftschadstoffe getriebenen Entstehung der atopischen Dermatitis beeinflusst.

Arbeitsgruppenleiter:
Thomas Haarmann-Stemmann
Die Bedeutung des Arylhydrocarbon-Rezeptors für die durch ultraviolette-B Strahlung induzierte DNS-Schadensantwort und die Entstehung von Hautkrebs
In diesem DFG-geförderten Forschungsprojekt untersuchen wir die Mechanismen durch die der liganden-aktivierte AHR die Nukelotidexzisionsreparatur beeinflusst. Mittels Durchführung von in vitro-Experimenten sowie Karzinogenesestudien testen wir die Hypothese, dass expositionsrelevante AHR-Agonisten, wie beispielsweise PAK, ko-karzinogen wirken und die UVB-induzierte Entstehung von kutanen Plattenepithelkarzinomen (PEK) verstärken. Die Ergebnisse dieser Untersuchungen sind insbesondere im Hinblick Personen, die täglich UV-Strahlung und PAKs ausgesetzt sind und somit ein erhöhtes Hautkrebsrisiko haben, wie z. B. Dachdecker und Straßenarbeiter, von klinischer Relevanz. Ein weiterer Aspekt, der in diesem Projekt untersucht wird, ist die potentielle anti-apoptotische Rolle des AHR in malignen Keratinozyten. Mit Hilfe diverser in vitro- wie in vivo-Analysen, untersuchen wir ob eine Hemmung des AHR kutane Krebszellen gegenüber genotoxischen Agentien sensibilisiert. Sollte sich diese These bestätigen, könnte dies eine Verminderung von Behandlungsdosis und -zeit und somit eine Optimierung topischer chemotherapeutischer Behandlungsstrategien erlauben.
Interaktion verschiedener im Sonnenlicht enthaltener UV-Wellenlängen
In enger Zusammenarbeit mit der Arbeitsgruppe von Jean Krutmann untersuchen wir die Interaktion verschiedener im Sonnenlicht enthaltener UV-Wellenlängen in humanen Keratinozyten und Mäusen. Die Rationale für dieses Projekt beruht auf dem artifiziellen Design der meisten photobiologischen Studien, welches entweder auf einer Bestrahlung des Testmodells mit nur einem Wellenlängenbereich des Sonnenlichts (z. B. UVB-Strahlung) oder einer sequentiellen Bestrahlung mit zwei oder mehr Bereichen (z. B. UVB zuerst, gefolgt von UVA) beruht. Im Kontrast hierzu, ist eine simultane Exposition gegenüber zwei oder mehreren Bereichen des Sonnenspektrums deutlich näher an der realen Exposition des Menschen. In diesem Projekt vergleichen wir daher die Effekte einer einzelnen und sequentiellen UVA- und UVB-Bestrahlung mit entsprechenden simultanen Expositionsprotokollen. In diesen Experimenten werden u.a. Parameter, wie DNA-Schäden, DNA-Reparatur, oxidativer Stress, Apoptose und Hautkarzinogenese, untersucht. Das übergeordnete Ziel ist es, das mechanistische Verständnis der adaptiven und maladaptiven Ereignisse, die durch solare UV-Strahlung in unserer Haut generiert werden, zu verbessern. Die Befunde dieses Forschungsprojekts können dazu beitragen, Strategien zur Photoprotektion der menschlichen Haut zu optimieren.
Identifizierung des epidermalen Wachstumsfaktorrezeptors (EGFR) als Zielstruktur für ubiquitär vorhandene organische Umweltschadstoffe
In dem Projekt untersuchen wir die potentielle Wechselwirkung von Dioxinen, polychlorierten Biphenylen (PCB) und strukturverwandten halogenierten aromatischen Kohlenwasserstoffen mit der extrazellulären Domäne (EZD) des EGFR. Zuvor haben wir erstmalig Aminosäurereste in der EZD des EGFR identifiziert, die für die Bindung des PCB-Kongeners 126 essentiell und für dessen anti-proliferative Wirkung auf epidermale Keratinozyten verantwortlich sind. In diesem Projekt möchten wir EGFR-bindende Umweltschadstoffe identifizieren und deren adverse Effekte auf die menschliche Haut auf zellulärer wie molekularer Ebene charakterisieren. Die Hemmung der Wachstumsfaktor-induzierten EGFR-Aktivierung und nachgeschalteter Signaltransduktion könnte einen bis dato unbekannten Wirkmechanismus für zahlreiche expositionsrelevante Schadstoffe darstellen. Ein tieferes Verständnis der zugrunde liegenden Mechanismen und Auswirkungen ist daher der Schlüssel zu einem besseren Verständnis und damit einhergehend zu einem verbesserten Schutz gegen diese Umweltschadstoffe. Dieses Forschungsprojekt wird von der Jürgen Manchot Stiftung gefördert.
Einfluss polyzyklischer aromatischer Kohlenwasserstoffe auf den kutanen Prostaglandin D2 Metabolismus und damit assoziierte Entzündungsreaktionen
Hintergrund des Forschungsprojekts ist unsere frühere Beobachtung, dass eine Behandlung mit PAKs die Expression der Prostaglandin D2 (PGD2)-reduzierenden Aldo-Keto-Reduktase (AKR) 1C3 über einen nicht-kanonischen AHR-Signalweg induziert. Die NADPH-abhängige Oxidoreduktase AKR1C3 katalysiert die 11-Ketoreduktion von PGD2, welches von degranulierenden Mastzellen freigesetzt wird und Th2-gesteuerte Entzündungsreaktionen in der Haut stimuliert, zu 9α,11β-PGF2. Dieser Metabolit ist ebenfalls bioaktiv, im Gegensatz zum parentalen PGD2 jedoch metabolisch stabil. Ziel dieses Projekts ist es, die funktionelle und klinische Relevanz der AHR-AKR1C3-Achse und die damit assoziierten Veränderungen im PGD2-Stoffwechsel im Hinblick auf die durch PAK-haltige partikuläre Luftschadstoffe-induzierte Entstehung der atopischen Dermatitis darzulegen. Zu diesem Zweck werden mechanistische Studien an Keratinozyten in 2D- und 3D-Kultur sowie humaner ex vivo-Haut durchgeführt. In enger Zusammenarbeit mit Tamara Schikowski und ihrer Arbeitsgruppe wird die klinische Relevanz des AKR1C3-Enzyms für die umweltinduzierte Entstehung bzw. Verschlechterung der atopischen Dermatitis auf Populationsebene untersucht. Dieses Projekt wird seitens der Jürgen Manchot Stiftung gefördert.
IUF-intern:
AG Esser
AG Krutmann
AG Schikowski
Core Unit GEMD (Rossi)
International:
Julien Dairou, University of Paris, Frankreich
Rodolfo Lavilla, University of Barcelona, Spanien
Motoki Nakamura, Nagoya City University, Japan
Christoph F.A. Vogel, University of California, Davis, CA, USA
Postdoc
- Stephanie Binder (gemeinsames Projekt mit Andrea Rossi)
- Hatice Genc
- Katharina Rolfes
Promovierende
Masterstudierende



